التطبيقات الرئيسية للإيتريوم في السبائك والفوسفور
مقدمة
يُعدالإيتريوم، وصيغته الكيميائية Y، أحد العناصر الأرضية النادرة نظراً لتشابه خواصه الفيزيائية والكيميائية مع العناصر الأرضية النادرة الأخرى ولأسباب تاريخية مبكرة . وهو فلز انتقالي فضي ناعم يشبه كيميائياً مجموعة اللانثانيدات، وخاصة مجموعة العناصر الأرضية النادرة الثقيلة، التي يتراوح عددها الذري من 63 إلى 71. التوزيع الإلكتروني للإيتريوم هو [Kr]5s24d1. ويفضل أن يفقد 3 إلكترونات لتكوين بنية مستقرة مكونة من 8 إلكترونات، لذا فإن حالة تأكسده هي +3.Y2O3هو أحد مركبات الإيتريوم الأكثر شيوعًا المستخدمة.
ويحتوي الإيتريوم على 31 جزء من المليون في القشرة الأرضية وهو العنصرالثامن والعشرون الأكثر وفرةً، وهو أكثر شيوعاً من الذهب Au بحوالي 26000 مرة. وعادةً ما يوجد الإيتريوم مع اللانثانيدات الأخرى في المعادن الأرضية النادرة كمنتج ثانوي. ويأتي معظم الإيتريوم من المصادر الثلاثة التالية:
- الزينوتيم: معدن فوسفاتي يحتوي على الإيتريوم أورثوفوسفات (YPO4)
- المونازيت: معدن فوسفات بني محمر يحتوي على عناصر أرضية نادرة
- الباستنازيت: معدن فلورو كربونات الكالسيوم يحتوي على السيريوم واللانثانوم والإيتريوم
يُستخدم الإيتريوم على نطاق واسع في العديد من المجالات مثل الفوسفور في أنابيب التلفزيون، والإضاءة الموفرة للطاقة، وخلايا الوقود [2]، والمعادن، والسيراميك، والموصلات الفائقة، وما إلى ذلك. ستركز هذه المقالة في الغالب على الإيتريوم المستخدم في السبائك والفوسفور.
الإيتريوم المستخدم في السبائك والفوسفور
يُستخدم الإيتريوم في صناعات السبائك بسبب تأثيراته في إزالة الأكسدة أو إزالة الكبريت أو إزالة النتروجين أو إزالة الغازات، والتي تفسر من خلال إمكانية أكسدته الديناميكية الحرارية المنخفضة [1]. يمكن أن تؤدي إضافة كمية من الإيتريوم إلى سبيكة Ni-20Cr، على سبيل المثال، إلى تحسين مقاومة الأكسدة في درجات الحرارة العالية كثيرًا. ولكن لا تزال الأسباب التفصيلية غير معروفة على الرغم من إجراء الكثير من الفرضيات والأبحاث. هناك تفسيران محتملان:
- يمكن لإضافة الإيتريوم أن يقلل من زيادة كتلة السبائك. (كسب الكتلة يعني زيادة الكتلة الكلية في السبيكة بسبب امتصاص الذرات أو الجزيئات من البيئة. وقد يحدث ذلك بسبب التآكل والأكسدة والترسيب).
- تعزز إضافة الإيتريوم من التصاق سطح السبائك.
هنا، تؤخذ سبائك الألومينا مع إضافة الإيتريوم كمثال.
سبيكة Fe-20Cr-4Al مع إضافة الإيتريوم
Fe-20Cr-4Al عبارة عن سبيكة مكونة من 20% كروم و4% أل، والحديد كالحديد المتوازن. وغالباً ما تستخدم في التطبيقات ذات درجات الحرارة العالية مثل غرف الاحتراق أو المبادلات الحرارية. وتتميز بمقاومة جيدة للأكسدة والتآكل في درجات الحرارة العالية.
فيما يلي الخطوات الخاصة بكيفية زرع الإيتريوم في سبيكة Fe-20Cr-4Al:
كرر الدرفلة على الساخن والبارد باستخدام سبيكة Fe-20Cr-4Al لصنع صفيحة بسماكة 0.5 مم. استخدام جهاز الزرع لزرع أيون الإيتريوم في السبيكة. استخدم مطيافية التشتت الخلفي لرذرفورد (RBS) لقياس تركيز الإيتريوم في السبيكة بدقة. نستخدم هنا سبائك مزروعة بنسبة 0.01% إلى 0.5% Y.
مناقشة التجربة والنتائج
استخدمنا سبائك Fe-20Cr-4Al-(0، 0.01، 0.02، 0.05، 0.1، 0.2، 0.5) Y وعرضناها تحت O2 لمدة 5 ساعات تحت 1200 ℃. يوضح الشكل 1 انخفاضًا في اكتساب الكتلة من Fe-20Cr-4Al إلى Fe-20Cr-4Al-0.1Y. بعد ذلك، يزداد اكتساب الكتلة مرة أخرى [1].
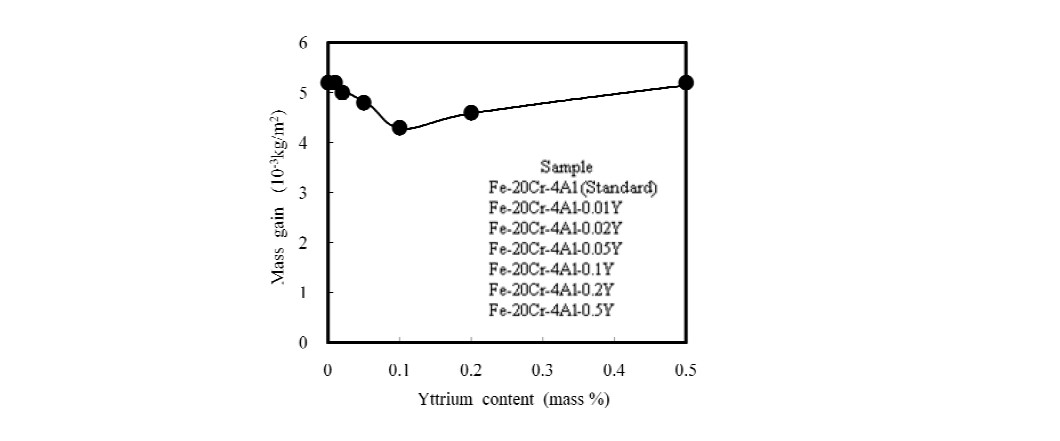
الشكل 1: التغير في الكسب الكتلي لسبائك Fe-20Cr-4Al-(0، 0.01، 0.02، 0.05، 0.1، 0.2، 0.3) Y تحت 5 ساعات عند 1200 ℃ في O2 [1].
يوضح الشكل 2 مظهر سطح هذه السبائك بعد التعرض للأكسجين. يبدأ سطح سبيكة FeCrAl القياسية FeCrAl في التساقط.
من (ب) إلى (ح)، يشكل كلاهما سطحًا من الأكسيد لحماية المادة في الوسط. (ب) و(ج) لا يزال هناك شظايا طفيفة على سطحها. مع زيادة تركيز الإيتريوم، يتشكل سطح الأكسيد بشكل أفضل لحماية نفسه. من 0.1 ص إلى 0.5 ص، تكون أسطحها أغمق بكثير من تلك التي تتراوح من 0.1 ص إلى 0.05 ص. باستخدام حيود الأشعة السينية للكشف عن سطح السبائك، نحصل على الملاحظات التالية [1].
(أ) تشكل بنية السطح البلورية Al2O3 الضعيفة للغاية. من (ب) إلى (ح)، تشكل جميعها Al2O3 قوي.
من (و) إلى (ح)، تُشكِّل أيضًا هياكل بلورية Y3Al5O12 ضعيفة جدًا.
Y3Al5O12، وتسمى أيضًا عقيق الإيتريا الألومينا (YAG)، وهي مادة اصطناعية تتميز بخصائص عالية الحرارة وعالية القوة ومستقرة كيميائيًا. قد يكون تشكيل YAG أحد أسباب زيادة اكتساب الكتلة من 0.1Y إلى 0.5Y. ولكن هذه الزيادة في اكتساب الكتلة لا تعني أن مقاومة السبيكة للأكسدة في درجات الحرارة العالية تقل. في الواقع، مع زيادة تركيز Y، تُظهر السبيكة مقاومة أفضل للأكسدة والتآكل في درجات الحرارة العالية.

الشكل 2: صور سطحية لسبائك FeCrAl-(0، 0.01، 0.02، 0.05، 0.1، 0.2، 0.3) Y تحت 5 ساعات عند 1200 درجة مئوية في O2 [1]. (أ) 0.0Y؛ (ب) 0Y مع التنقية؛ (ج) 0.01Y؛ (د) 0.02Y؛ (هـ) 0.05Y؛ (و) 0.1Y؛ (ز) 0.2Y؛ (ح) 0.3Y
الإيتريوم المستخدم في الفوسفور
الفوسفورات هي مواد تستقبل الإشعاع وتبعث الضوء. والمبدأ الأساسي هو أن الإلكترونات المدارية للفوسفور تستقبل طاقة الإشعاع وتصبح مثارة وتنتقل إلى مدارات أعلى. وأخيرًا، تعود هذه الإلكترونات إلى حالاتها الأرضية. الطاقة الناتجة عن هذا السلوك ستبعث الضوء.
تؤثر العناصر المستخدمة في الفوسفور تأثيرًا مباشرًا على الضوء الذي يبعثه الفوسفور. ونظرًا لانبعاث الإيتريوم الأحمر المستقر والضيق والفعال الذي يتميز به الإيتريوم Y2O3، يُستخدم Y2O3 في الفوسفور لأجهزة التلفاز الملونة وشاشات الكمبيوتر والصمامات الثنائية الباعثة للضوء (LED) والشاشات المعززة بالأشعة السينية [2].
تنتج مصابيح LED العامة ضوء أبيض بارد. أما الصمامات الثنائية الباعثة للضوء الأبيض الدافئ المحول بالفوسفور (pc-WLEDs) فهي تقنية LED الجديدة [3]. يمكن أن يضيف Y2O3 بحجم النانو بعض المكونات الحمراء في الفوسفور لجعل الصمام الثنائي الباعث للضوء (LED) ينبعث منه ضوء أكثر دفئًا وعالي الجودة.
الخلاصة
الإيتريوم هو أحد العناصر الأرضية النادرة. نظرًا لخصائصه الفريدة، يستخدم Y على نطاق واسع في الفوسفور والسبائك. لا يزال هناك العديد من التطبيقات ومركبات الإيتريوم التي لم يتم ذكرها اليوم. توفر Stanford Advanced Materials (SAM) أنواعًا مختلفة من الإيتريوم. إذا كنت تريد المزيد من المعلومات حول مركبات الإيتريوم أو مركبات الإيتريوم، يمكنك تقديم معلومات التطبيق الخاص بك إلى موظفينا الفنيين للحصول على المشورة.
المرجع
- فولكيرتس، ب. د. (محرر). (2010). الإيتريوم: المركبات والإنتاج والتطبيقات: المركبات والإنتاج والتطبيقات. Nova Science Publishers, Incorporated.
- Zhang, K., K., Kleit, A. N., &؛ Nieto, A. (2017). استراتيجية اقتصادية للحرجية - تطبيق على عنصر الإيتريوم الأرضي النادر في تكنولوجيا الإضاءة الجديدة وتوافره المستدام. Renewable and Sustainable Energy Reviews, 77, 899-915. https ://doi.org/10.1016/j.rser.2016.12.127
- Petry, J., Komban, R., Gimmler, C., &؛ Weller, H. (2022). التوليف البسيط في وعاء واحد لمصابيح LED البيضاء الدافئة المحولة بالفوسفور لمصابيح LED البيضاء الدافئة المخدرة بأكسيد الإيتريوم y2O3: eu. Nanoscale Advances, 4(3), 858-864. https://doi.org/10 .1039/d1na00831e

 القضبان
القضبان
 الخرز والكرات
الخرز والكرات
 البراغي والصواميل
البراغي والصواميل
 البوتقات
البوتقات
 الأقراص
الأقراص
 الألياف والأقمشة
الألياف والأقمشة
 الأفلام
الأفلام
 فليك
فليك
 الرغاوي
الرغاوي
 رقائق معدنية
رقائق معدنية
 الحبيبات
الحبيبات
 أقراص العسل
أقراص العسل
 الحبر
الحبر
 صفائح
صفائح
 الكتل
الكتل
 التشابك
التشابك
 غشاء معدني
غشاء معدني
 اللوحة
اللوحة
 المساحيق
المساحيق
 قضيب
قضيب
 الصفائح
الصفائح
 البلورات المفردة
البلورات المفردة
 هدف الاخرق
هدف الاخرق
 الأنابيب
الأنابيب
 الغسالة
الغسالة
 الأسلاك
الأسلاك
 المحولات والآلات الحاسبة
المحولات والآلات الحاسبة



 Chin Trento
Chin Trento



