الليثيوم: خصائص العنصر واستخداماته
فهم عنصر الليثيوم
ما هو الليثيوم؟
الليثيوم، رقمه الذري 3 ورمزه Li، هو أخف فلز في الجدول الدوري وفلز قلوي. وخلال قرنين من وجوده كفضول مختبري، تطور الليثيوم إلى سلعة صناعية متداولة عالميًا. واليوم، يُعتبر تكرير الليثيوم وإنتاجه - من خلال التحليل الكهربائي للملح أو طحن المعادن مثل السبودومين - أساساً لصناعة بمليارات الدولارات في مجال تخزين الطاقة واستكشاف الفضاء والإلكترونيات.

وصف الخواص الكيميائية
تعكس الخصائص الكيميائيةلليثيوم خصائصه الكيميائية خصائصه الفيزيائية باعتبارها مميزة بنفس القدر:
-التفاعل: يتفاعل الليثيوم بقوة مع الماء لتكوين هيدروكسيد الليثيوم (LiOH) وغاز الهيدروجين. على سبيل المثال، يمكن لقطعة صغيرة من الليثيوم المغمورة في الماء أن تُحدث فورانًا مرئيًا في غضون ثوانٍ.
-الطبيعة القلوية: كونه فلزًا قلويًا آخر، يتخلى الليثيوم بسهولة عن إلكترونه الخارجي الواحد لإنتاج أيون الليثيوم، وبالتالي يصبح لاعبًا مهمًا في التفاعلات الكهروكيميائية، بما في ذلك في بطاريات أيونات الليثيوم.
- قابلية الاشتعال: يشتعل الليثيوم بلهب أحمر مميز، وهو ما يجب أن يضعه المهندسون في اعتبارهم أثناء العمل مع الليثيوم السائب وتخزينه.
جدول بيانات الخواص الفيزيائية
|
الخاصية |
القيمة |
|
العدد الذري |
3 |
|
الوزن الذري |
6.94 جم/مول |
|
درجة الانصهار |
180.54 °C |
|
درجة الغليان |
1590 °C |
|
الكثافة |
0.534 جم/سم مكعب |
|
المظهر |
معدن أبيض فضي اللون |
|
الصلابة |
ناعم |
|
الموصلية الكهربائية |
عالية |
|
الموصلية الحرارية |
عالية |
اكتشاف الليثيوم
اكتُشف الليثيوم لأول مرة في عام 1817 في البتاليت في جزيرة أوتو بالسويد. وكشف تحليل أرففيدسون عن عنصر جديد غير معروف له خصائص أخرى غير الصوديوم أو البوتاسيوم. تم فصل الليثيوم المعدني لاحقًا، عن طريق التحليل الكهربائي لأملاح الليثيوم، حتى يتمكن العلماء والمهندسون من إجراء مزيد من التحليل لخصائصه الفيزيائية والكيميائية. وبمرور الوقت، أدى هذا المزيج الغريب من خفة الليثيوم وتفاعليته العالية وإمكاناته الكهروكيميائية إلى وضعه على مسار من تخزين الطاقة إلى الشحوم الصناعية والأدوية.
سبائك ومركبات الليثيوم
- سبائك الليثيوم والألومنيوم: خفيفة وصعبة للغاية، وتستخدم في مكونات الطائرات وأجزاء السيارات الرياضية.
- سبائك الليثيوم والنحاس: تضفي توصيلًا كهربائيًا محسنًا، وغالبًا ما تستخدم في الموصلات والدوائر الإلكترونية.
- فوسفات الليثيوم-الحديد (LiFePO₄): شائع الاستخدام في كاثودات بطاريات السيارات الكهربائية بسبب ثباته وطول دورة حياته.
- هيدروكسيد الليثيوم (LiOH) والكربونات (Li₂CO₃): ذات أهمية رئيسية في بطاريات إعادة الشحن وشحوم التشحيم والعمليات الكيميائية الصناعية.
- كلوريد الليثيوم (LiCl): يستخدم في المجففات ومكيفات الهواء والتركيب الكيميائي.
على سبيل المثال، تستخدم شركة Tesla وغيرها من الشركات المصنعة للسيارات الكهربائية بطاريات فوسفات الليثيوم والحديد (LFP) في أساطيل سيارات معينة، حيث يكون الاستقرار الحراري وكثافة الطاقة أمرًا بالغ الأهمية لضمان السلامة والأداء الوظيفي.
التطبيقات الشائعة
هناك تطبيقات مختلفة لليثيوم:
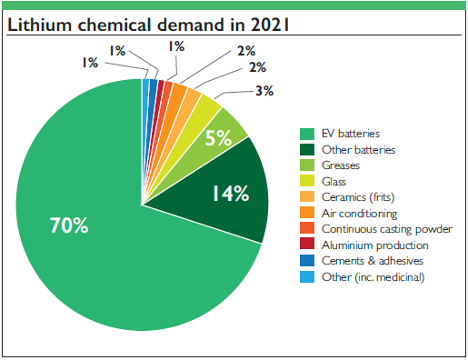
1. البطاريات: تهيمن بطاريات الليثيوم أيون وبطاريات الليثيوم بوليمر على السوق في الإلكترونيات المحمولة والمركبات الكهربائية وأنظمة تخزين الطاقة المتجددة بسبب كثافة الطاقة العالية.
2. السبائك: يخفف الليثيوم من خلائط الألومنيوم والنحاس، مما يحسن من كفاءة صناعة الطيران دون فقدان القوة.
3. الاستخدامات الطبية: تعمل كربونات الليثيوم على استقرار حالة المرضى المصابين بالاضطراب ثنائي القطب، مما يدل على تأثير الليثيوم الذي يتجاوز الاستخدامات الصناعية.
4. الزجاج والسيراميك المقاوم للحرارة: يعزز الليثيوم مقاومة الصدمات الحرارية والقوة.
5. شحوم التشحيم: تتمتع شحوم الليثيوم بأداء جيد مع درجات الحرارة والضغوط العالية، وهي ضرورية في الصناعات التحويلية وصناعات السيارات.
 [1]
[1]
عمليات التحضير
يتم الحصول على الليثيوم في المقام الأول من خلال:
1. يتم استرداد معدن الليثيوم من LiCl أو LiF من خلال التحليل الكهربائي للحصول على درجة نقاء عالية لتطبيقات السوق.
2. تعدين المعادن: تتم معالجة السبودومين والبتاليت لتكوين كربونات الليثيوم أو هيدروكسيد الليثيوم لاستخدامه في إنتاج البطاريات والمواد الكيميائية.
الأسئلة المتداولة
ما هي الاستخدامات الأكثر شيوعاً لليثيوم؟
في المقام الأول في البطاريات القابلة لإعادة الشحن، والسبائك الخفيفة، وشحوم التشحيم، والمستحضرات الصيدلانية.
كيف يتم استخراج الليثيوم؟
من خلال التحليل الكهربائي لأملاح الليثيوم أو من خامات معدن السبودومين.
هل الليثيوم تفاعلي؟
نعم، خاصةً مع الماء، لتكوين LiOH وغاز الهيدروجين.
ما هي بطاريات أيونات الليثيوم؟
توفر الطاقة للهواتف الذكية، وأجهزة الكمبيوتر المحمولة، والمركبات الكهربائية، وأنظمة تخزين الطاقة المتجددة بسبب كثافة الطاقة العالية والعمر الطويل للدورة.
مرجع:
[1] الرابطة الدولية لليثيوم (2023، 13 أكتوبر). الليثيوم 101. تم الاسترجاع 17 يوليو 2025، من https ://lithium. org/lithium-101/

 القضبان
القضبان
 الخرز والكرات
الخرز والكرات
 البراغي والصواميل
البراغي والصواميل
 البوتقات
البوتقات
 الأقراص
الأقراص
 الألياف والأقمشة
الألياف والأقمشة
 الأفلام
الأفلام
 فليك
فليك
 الرغاوي
الرغاوي
 رقائق معدنية
رقائق معدنية
 الحبيبات
الحبيبات
 أقراص العسل
أقراص العسل
 الحبر
الحبر
 صفائح
صفائح
 الكتل
الكتل
 التشابك
التشابك
 غشاء معدني
غشاء معدني
 اللوحة
اللوحة
 المساحيق
المساحيق
 قضيب
قضيب
 الصفائح
الصفائح
 البلورات المفردة
البلورات المفردة
 هدف الاخرق
هدف الاخرق
 الأنابيب
الأنابيب
 الغسالة
الغسالة
 الأسلاك
الأسلاك
 المحولات والآلات الحاسبة
المحولات والآلات الحاسبة
 اكتب لنا
اكتب لنا




 Chin Trento
Chin Trento



